Kompetensi : mahasiswa dapat mengenali bentuk dan morfologi sel dan koloni mikroorganisme
a. Bakteri
a.1 mengamati morfologi koloni bakteri
a.1.1 pada media cawan
a.1.2 pada agar miring
a.1.3 pada agar tegak
a.1.4 pada media cair
a.2 mengamati morfologi sel bakteri
a.2.1 dengan pewarnaan sederhana
a.2.2 dengan pewarnaan negatif
a.2.3 dengan pewarnaan gram
a.2.4 dengan pewarnaan endospora
a.3 mengamati motilitas bakteri
a.3.1 pengamatan langsung
a.3.2 pengamatan tidak langsung
b. Yeast
b.1 mengamati morfologi koloni yeast (pada agar cawan)
b.2 mengamati morfologi sel yeast (dengan pewarnaan sederhana)
c. Kapang
c.1 mengamati morfologi koloni kapang (pada agar cawan)
c.2 mengamati morfologi sel kapang (dengan metode slide culture)
Bakteri
A. Mengamati Morfologi Koloni Bakteri
Kegiatan ini merupakan tindakan pertama kali jika ingin mempelajari suatu jenis bakteri lebih lanjut, khususnya untuk tujuan identifikasi. Setelah mendapatkan kultur murni maka biakan yang diinginkan ditumbuhkan ke berbagai bentuk media untuk dikenali ciri koloninya.
Cara Kerja :
· Tumbuhkan biakan pada media NA cawan dengan streak kuadran
· Tumbuhkan biakan pada media NA miring dengan pola inokulasi yang tegak lurus
· Tumbuhkan biakan pada media NA tegak dengan stab inoculation
· Tumbuhkan biakan pada media NB
A.1. Pertumbuhan pada Cawan Petri
Ciri-ciri yang perlu diperhatikan adalah sebagai berikut :
·  Ukuran; pinpoint/punctiform (titik)
Ukuran; pinpoint/punctiform (titik)Small (kecil)
Moderate (sedang)
Large (besar)
· Pigmentasi : mikroorganisme kromogenik sering memproduksi pigmen intraseluler, beberapa jenis lain memproduksi pigmen ekstraseluler yang dapat terlarut dalam media
· Karakteristik optik : diamati berdasarkan jumlah cahaya yang melewati koloni.
Opaque (tidak dapat ditembus cahaya), Translucent (dapat ditembus cahaya sebagian), Transparant (bening)

· Bentuk :
Circular
Irregular
Spindle
Filamentous
Rhizoid
- Elevasi :
Flat
Raised
Convex
Umbonate
· Permukaan :
Halus mengkilap
Kasar
Berkerut
Kering seperti bubuk
· Margins :

Entire
Lobate
Undulate
Serrate
Felamentous
Curled
A.2. Pertumbuhan pada Agar Miring
Ciri-ciri koloni diperoleh dengan menggoreskan jarum inokulum tegak dan lurus
Ciri koloni berdasarkan bentuk:
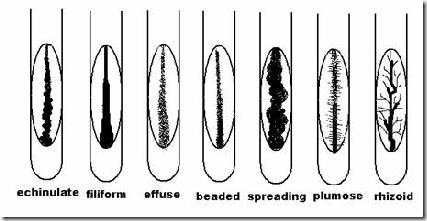
A.3 Pertumbuhan pada Agar Tegak
Cara penanaman adalah dengan menusukkan jarum inokulum needle ke dalam media agar tegak.
Ciri-ciri koloni berdasar bentuk :

Ciri koloni berdasar kebutuhan O2 :
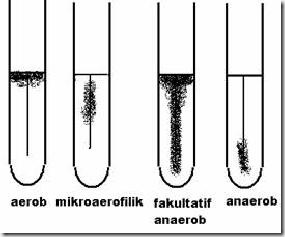
A.4 Pertumbuhan pada Media Cair
Pola pertumbuhan berdasarkan kebutuhan O2
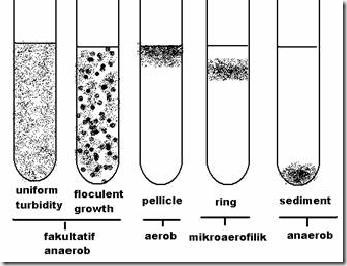
A. Mengamati Morfologi Bakteri
Sel bakteri dapat teramati dengan jelas jika digunakan mikroskop dengan perbesaran 100x10 yang ditambah minyak imersi. Jika dibuat preparat ulas tanpa pewarnaan, sel bakteri sulit terlihat. Pewarnaan bertujuan untuk memperjelas sel bakteri dengan menempelkan zat warna ke permukaan sel bakteri. Zat warna dapat mengabsorbsi dan membiaskan cahaya, sehingga kontras sel bakteri dengan sekelilingnya ditingkatkan.
Zat warna yang digunakan bersifat asam atau basa. Pada zat warna basa, bagian yang berperan dalam memberikan warna disebut kromofor dan mempunyai muatan positif. Sebaliknya pada zat warna asam bagian yang berperan memberikan zat warna memiliki muatan negatif. Zat warna basa lebih banyak digunakan karena muatan negatif banyak banyak ditemukan pada permukaan sel. Contoh zat warna asam antara lain Crystal Violet, Methylene Blue, Safranin, Base Fuchsin, Malachite Green dll. Sedangkan zat warna basa antara lain Eosin, Congo Red dll.
Pewarnaan
· Pewarnaan sederhana
- pewarnaan positif
- pewarnaan negatif
· Pewarnaan diferensial
- pewarnaan gram
- pewarnaan acid fast dll.
· Pewarnaan khusus
- pewarnaan endospora
- pewarnaan flagella dll.
B.1. Pewarnaan Sederhana (Pewarnaan Positif)
Sebelum dilakukan pewarnaan dibuat ulasan bakteri di atas object glass yang kemudian difiksasi. Jangan menggunakan suspensi bakteri yang terlalu padat, tapi jika suspensi bakteri terlalu encer, maka akan diperoleh kesulitan saat mencari bakteri dengan mikroskop. Fiksasi bertujuan untuk mematikan bakteri dan melekatkan sel bakteri pada object glass tanpa merusak struktur selnya.
Cara Kerja :
· Bersihkan object glass dengan kapas
· Jika perlu tulislah kode atau nama bakteri pada sudut object glass
· Bila menggunakan biakan cair maka pindahkan setetes biakan dengan pipet tetes atau dapat juga dipindahkan dengan jarum inokulum. Jangan lupa biakan dikocok terlebih dahulu. Jika digunakan biakan padat, maka biakan dipindahkan dengan jarum inokulum, satu ulasan saja kemudian diberi akuades dan disebarkan supaya sel merata.
· Keringkan ulasan tersebut sambil memfiksasinya dengan api bunsen (lewatkan di atas api 2-3 kali)
· Setelah benar-benar kering dan tersebar selanjutnya ditetesi dengan pewarna (dapat digunakan Methylen blue, Safranin, Crystal Violet) dan tunggu kurang lebih 30 detik.
· Cuci dengan akuades kemudian keringkan dengan kertas tissue
· Periksa dengan mikroskop (perbesaran 100 x 10).
B.2 Pewarnaan Negatif
Beberapa bakteri sulit diwarnai dengan zat warna basa. Tapi mudah dilihat dengan pewarnaan negatif. Zat warna tidak akan mewarnai sel melainkan mewarnai lingkungan sekitarnya, sehingga sel tampak transparan dengan latar belakang hitam.
Prosedur:
· Ambil dua object glass, teteskan nigrosin atau tinta cina di ujung kanan salah satu object glass
· Biakan diambil lalu diulaskan atau diteteskan dalam tetesan nigrosin tadi, lalu dicampurkan
· Tempelkan sisi object glass yang lain kemudian gesekkan ke samping kiri
· Biarkan preparat mengering di udara, jangan difiksasi atau dipanaskan di atas api.
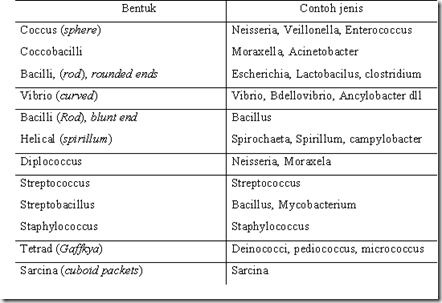
Setelah dilihat di mikroskop, maka akan tampak bentuk sel bakteri. Berikut merupakan berbagai bentuk sel bakteri
A.3. Pewarnaan Gram
Adalah pewarnaan diferensial yang sangat berguna dan paling banyak digunakan dalam laboratorium mikrobiologi, karena merupakan tahapan penting dalam langkah awal identifikasi. Pewarnaan ini didasarkan pada tebal atau tipisnya lapisan peptidoglikan di dinding sel dan banyak sedikitnya lapisan lemak pada membran sel bakteri. Jenis bakteri berdasarkan pewarnaan gram dibagi menjadi dua yaitu gram positif dan gram negatif. Bakteri gram positif memiliki dinding sel yang tebal dan membran sel selapis. Sedangkan baktri gram negatif mempunyai dinding sel tipis yang berada di antara dua lapis membran sel.Berikut merupakan tabel prosedur pewarnaan Gram:
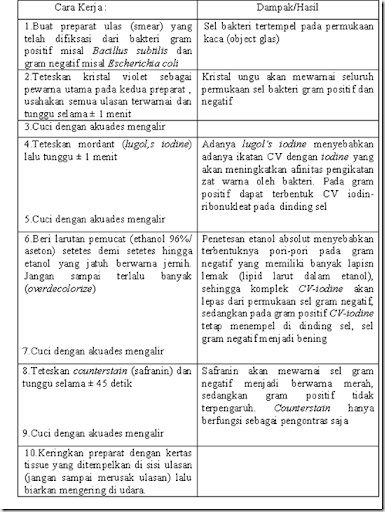
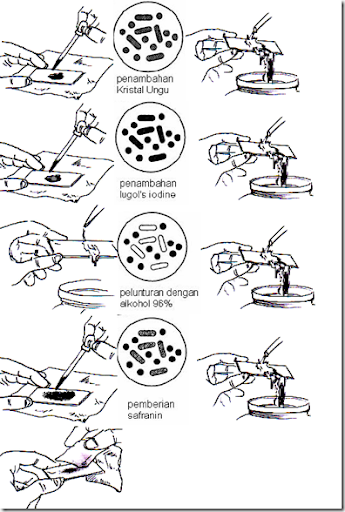
Hal-hal yang perlu diperhatikan dalam pewarnaan gram adalah sbb:
· Fase yang paling kritis dari prosedur di atas adalah tahap dekolorisasi yang mengakibatkan CV-iodine lepas dari sel. Pemberian ethanol jangan sampai berlebih yang akan menyebabkan overdecolorization sehingga sel gram positif tampak seperti gram negatif. Namun juga jangan sampai terlalu sedikit dalam penetesan etanol (underdecolorization) yang tidak akan melarutkan CV-iodine secara sempurna sehingga sel gram negatif seperti gram positif.
· Preparasi pewarnaan gram terbaik adalah menggunakan kultur muda yang tidak lebih lama dari 24 jam. Umur kultur akan berpengaruh pada kemampuan sel menyerap warna utama (CV), khususnya pada gram positif. Mungkin akan menampakkan gram variabel yaitu satu jenis sel, sebagian berwarna ungu dan sebagian merah karena pengaruh umur. Walaupun ada beberapa species yang memang bersifat gram variabel seperti pada genus Acinetobacter dan Arthrobacter.
B.4. Pewarnaan Endospora
Anggota dari genus Clostridium, Desulfomaculatum dan Bacillus adalah bakteri yang memproduksi endospora dalam siklus hidupnya. Endospora merupakan bentuk dorman dari sel vegetatif, sehingga metabolismenya bersifat inaktif dan mampu bertahan dalam tekanan fisik dan kimia seperti panas, kering, dingin, radiasi dan bahan kimia. Tujuan dilakukannya pewarnaan endospora adalah membedakan endospora dengan sel vegetatif, sehingga pembedaannya tampak jelas.
Endospora tetap dapat dilihat di bawah mikroskop meskipun tanpa pewarnaan dan tampak sebagai bulatan transparan dan sangat refraktil. Namun jika dengan pewarnaan sederhana, endospora sulit dibedakan dengan badan inklusi (kedua-duanya transparan, sel vegetatif berwarna), sehingga diperlukan teknik pewarnaan endospora. Berikut merupakan prosedur pewarnaan endospora dengan metode Schaeffer-Fulton.
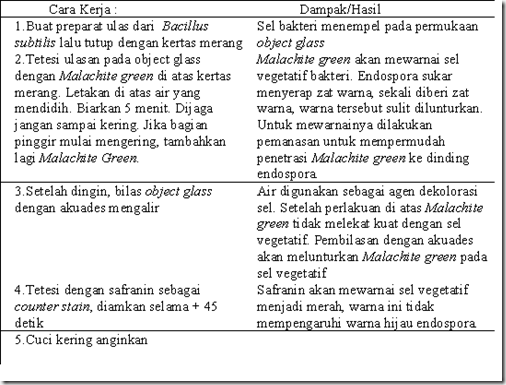
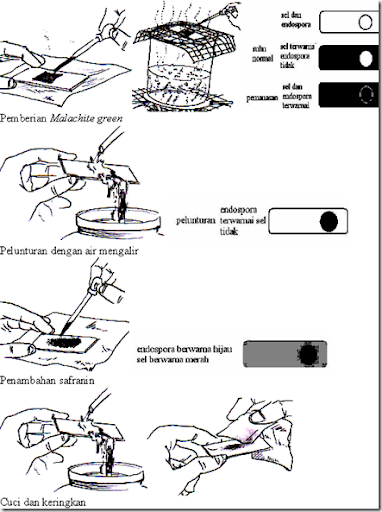
Berikut merupakan beberapa tipe endospora dan contohnya
C. Mengamati motilitas
C.1 Pengamatan Langsung
Cara Kerja :
· Teteskan biakan bakteri motil seperti Bacillus atau E.coli ke object glass (sebaiknya dari biakan cair). Jika digunakan biakan padat maka ulas dengan jarum inokulum lalu ditambah akuades satu tetes, ratakan.
· Tutup dengan cover glass
· Amati menggunakan mikroskop dengan perbesaran maksimak. Bakteri akan tampak transparan dan pola pergerakannya tidak beraturan. Hati-hati jangan salah membedakan antara sel yang bergerak sendiri karena flagel atau bergerak terkena aliran air.
C.2 Pengamatan tidak langsung
· Tanam biakan pada media NA tegak atau Media Motilitas dengan cara tusuk (Stab inoculation) sedalam + 5 mm.
· Inkubasi pada suhu 370 C selama 1x 24 jam
· Hasil positif (motil) jika bakteri tumbuh pada seluruh permukaan media, hasil negatif menunjukan bakteri hanya tumbuh pada daerah tusukan saja
Bakteri motil akan bermigrasi ke seluruh permukaan agar dan bekas tusukan
A. Mengamati morfologi koloni yeast
· Tanam biakan yeast (dapat berupa Sacharomyces cereviceae atau Candida albicans) pada PDA dengan cara streak quadrant.
· Inkubasi selama 2x24 jam.
· Setelah didapatkan koloni tunggal, pengamatan ciri-ciri morfologi koloni hampir sama dengan ciri morfologi bakteri.
B. Mengamati Morfologi Sel Yeast
Yeast merupakan fungi mikroskopik uniseluler, tidak membentuk hifa (beberapa spesies dapat membentuk pseudohifa). Bentuk selnya bervariasi dapat berbentuk bulat, bulat telur, bulat memanjang dengan ukuran 1-9x20 μm. Beberapa spesies yeast memiliki sifat dimorfisme yaitu bentuk sel tunggal dan bentuk hifa atau pseudohifa. Pseudohifa adalah hifa yeast yang terbentuk dari rangkaian sel hasil pembelahan aseksual secara budding, tetapi tidak melepaskan diri dari induk. Morfologi internal sel mudah dilihat dan terdiri dari inti dan organel seperti mitkondria, grannula lemak dan glikogen.
B.1 Melihat bentuk sel Yeast
Cara Kerja :
· Tumbuhkan Sacharomyces cereviceae pada glukosa cair selama 24 jam.
· Ulaskan suspensi biakan pada object glass lalu teteskan Methilene Blue hingga rata (jangan difiksasi).
· Tutup preparat dengan cover glass.
· Amati dengan perbesaran 40x10 atau 100x10.
B.2 Melihat bentuk spora sel Yeast
Cara kerja :
· Buat preparat ulas dari biakan yeast pada Goodkowa Agar yang berumur 10 hari.
· Fiksasi dengan api bunsen.
· Warnai dengan cara Shager dan Fulgen yaitu:
Tetesi preparat dengan Malachite Green dan biarkan 30-60 detik. Panasi preparat dengan api bunsen selama + 30 detik (sampai timbul uap). Cuci preparat dengan air mengalir. Keringkan dengan tissue kemudian biarkan pada udara terbuka. Amati di bawah mikroskop. Perhatikan spora yang berwarna
Kapang / Jamur
![clip_image010[7]](http://lh3.ggpht.com/_kFz4vOoppxQ/SSKnajNSGxI/AAAAAAAAAac/vqjAknTE0Eg/clip_image0107_thumb3.jpg) Jamur merupakan mikroba dengan struktur talus berupa benang-benang (hifa) yang terjalin seperti jala (myselium). Hifa dapat berekat (septat) dengan inti tunggal/ lebih dan hifa tidak bersekat (aseptat). Penampakan morfologi koloni pada umumnya seperti benang (filamentous) yang pertumbuhannya membentuk lingkaran. Morfologi koloninya dapat dengan mudah dibedakan dengan bakteri walaupun ada beberapa jenis bakteri yang koloninya mirip jamur, seperti dari kelompok Actinomycetes atau Bacillus mycoides. Koloni kapang memiliki keragaman warna yang muncul dari sporanya.
Jamur merupakan mikroba dengan struktur talus berupa benang-benang (hifa) yang terjalin seperti jala (myselium). Hifa dapat berekat (septat) dengan inti tunggal/ lebih dan hifa tidak bersekat (aseptat). Penampakan morfologi koloni pada umumnya seperti benang (filamentous) yang pertumbuhannya membentuk lingkaran. Morfologi koloninya dapat dengan mudah dibedakan dengan bakteri walaupun ada beberapa jenis bakteri yang koloninya mirip jamur, seperti dari kelompok Actinomycetes atau Bacillus mycoides. Koloni kapang memiliki keragaman warna yang muncul dari sporanya.A. Mengamati morfologi koloni kapang
Cara kerja :
· Tanam/pindahkan biakan kapang dengan jarum inokulum needle yang diletakan di tenganh-tengah cawan petri.
· Inkubasi selam beberapa hari.
· Amati pertumbuhan koloni (miselium) yang menyebar.
B. Mengamati sel morfologi kapang dengan metode Slide Culture (Microculture)
Teknik ini bertujuan untuk mengamati sel kapang dengan menumbuhkan spora pada object glass yang ditetesi media pertumbuhan. Pengamatan struktur spora dan miselium dapat juga dilakukan dengan preparat ulas seperti yang telah diuraikan di depan. Namun seringkali miselium atau susunan spora menjadi pecah atau terputus sehingga penampakan di mikroskop dapat membingungkan. Dengan teknik ini, spora dan miselium tumbuh langsung pada slide sehingga dapat mengatasi masalah tersebut.
B.1 Metode Heinrich’s, cara kerja :
· Siapkan object glass, cover glass, tissue basah yang dimasukkan dalam cawan dan sterilkan dengan autoclave.
· Setelah selesai sterilisasi berikan lilin (parafin-petrolatum) steril pada sebelah kiri dan kanan tempat yang akan ditutup cover glass (aseptis).
· Tutup dengan cover glass.
· Teteskan suspensi spora jamur dalam media cair pada media cover glass yang tidak diberi lilin. Berikan sampai setengah luasan cover glass. Tekan cover galss secara media merata.
· Inkubasi pada suhu kamar selama 3x24 jam.
· Ambil preparat dan amati di bawah mikroskop.
B. 2 Metode Riddel, cara kerja :
· Persiapan sama seperti di atas
· Setelah semua steril, potong media Saboraud Dextrose Agar steril berbentuk kubus dan letakkan di atas object glass.
· Inokulasikan spora jamur pada bagian atau potongan agar.
· Tutup potongan agar dengan cover glass.
· Inkubasi pada suhu kamar selama 3x24 jam.
· Ambil preparat dan diamati di bawah mikroskop.
B.3 Prosedur yang lebih sederhana, cara kerja :
· Sterilkan cawan petri yang berisi kapas yang di atasnya terdapat object glass dan cover glass.
· Siapkan media PDA dan dijaga supaya tetap cair.
· Teteskan media PDA pada object glass secara aseptis lalu tunggu memadat (teteskan jangan terlalu banyak).
· Belah media yang memadat dengan jarum inokulum yang berujung L.
· Ulaskan spora jamur yang akan diamati pada belahan tersebut.
· Tutup dengan cover glass tepat di atas media dan tekan hingga merata.
· Inkubasi selama 2x24 jam.
· Amati pertumbuhan miselium dan spora pada object glass dengan perbesaran sedang

![clip_image002[5]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKmeNxpANI/AAAAAAAAAYg/WKha7EHzDGk/clip_image0025_thumb1.jpg)
![clip_image004[5]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKmgrC5Q1I/AAAAAAAAAYo/_t__2ypgUYY/clip_image0045_thumb2.jpg)
![clip_image006[5]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKmjaViUEI/AAAAAAAAAYw/0jhe9oM-zu8/clip_image0065_thumb.jpg)
![clip_image008[6]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKmlz2uf8I/AAAAAAAAAY4/F4mA6oasZfc/clip_image0086_thumb.jpg)
![clip_image010[5]](http://lh3.ggpht.com/_kFz4vOoppxQ/SSKmoR-TSYI/AAAAAAAAAZA/TkzXJKOP6RU/clip_image0105_thumb.jpg)
![clip_image002[7]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKmvHxPVCI/AAAAAAAAAZQ/5PjfPerXnuo/clip_image0027_thumb1.jpg)
![clip_image002[9]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKnOMuxLuI/AAAAAAAAAZ8/NuAf5pR7Co4/clip_image0029_thumb1.jpg)
![clip_image004[7]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKnRxCooSI/AAAAAAAAAaE/oamHKlazsRg/clip_image0047_thumb1.jpg)
![clip_image006[7]](http://lh5.ggpht.com/_kFz4vOoppxQ/SSKnUgOA_2I/AAAAAAAAAaM/K-wgdog6WYE/clip_image0067_thumb2.jpg)
![clip_image008[8]](http://lh4.ggpht.com/_kFz4vOoppxQ/SSKnXVv4K1I/AAAAAAAAAaU/EaSsiPed1sc/clip_image0088_thumb2.jpg)
![clip_image012[5]](http://lh5.ggpht.com/_kFz4vOoppxQ/SSKngLVyh_I/AAAAAAAAAak/_G6G-udqS6E/clip_image0125_thumb1.jpg)
![clip_image014[6]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKnj3k453I/AAAAAAAAAas/i3-9NkBao_M/clip_image0146_thumb1.jpg)
![clip_image016[5]](http://lh6.ggpht.com/_kFz4vOoppxQ/SSKnoD6LaKI/AAAAAAAAAa0/rNyM_d2bY5A/clip_image0165_thumb1.jpg)





