Kompetensi : mahasiswa mengenal dan mengetahui fungsi dari tiap-tiap alat
Berikut daftar alat-alat mikrobiologi yang perlu dikenal:
Alat-alat elektrik
· Mikroskop cahaya
· Mikroskop stereo
· Autoklaf elektrik
· Incubator
· Hot plate & stirrer
· Colony counter
· Biological Safety Cabinet (BSC)
· Mikropipet
Alat-alat gelas dan keramik
· Cawan Petri
· Pipet ukur
· Pipet tetes
· Tabung reaksi
· Labu Erlenmeyer
· Glass beads
· Mortar & pestle
· Beaker glass
· Bunsen burner
· Gelas ukur
· Batang L / Drugalsky
· Tabung durham
Alat-alat non gelas
· Jarum inokulum / ose
· Pinset
· Rubber bulb
· pH meter universal
· Mikroskop Cahaya (Brightfield Microscope)
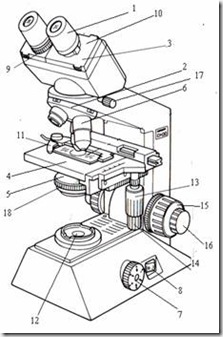
Salah satu alat untuk melihat sel mikroorganisme adalah mikroskop cahaya. Dengan mikroskop kita dapat mengamati sel bakteri yang tidak dapat dilihat dengan mata telanjang. Pada umumnya mata tidak mampu membedakan benda dengan diameter lebih kecil dari 0,1 mm. berikut merupakan uraian tentang cara penggunaan bagian-bagiandan spesifikasi mikroskop cahaya merk Olympus CH20 yang dimiliki Laboratorium Mikrobiologi.
Bagian-bagian Mikroskop:
- Eyepiece / oculars (lensa okuler)
Untuk memperbesar bayangan yang dibentuk lensa objektif
- Revolving nosepiece (pemutar lensa objektif)
Untuk memutar objektif sehingga mengubah perbesaran
- Observation tube (tabung pengamatan / tabung okuler)
- Stage (meja benda)
Spesimen diletakkan di sini
- Condenser (condenser)
Untuk mengumpulkan cahaya supaya tertuju ke lensa objektif
- Objective lense (lensa objektif)
Memperbesar spesimen
- Brightness adjustment knob (pengatur kekuatan lampu)
Untuk memperbesar dan memperkecil cahaya lampu
- Main switch (tombol on-off)
- Diopter adjustmet ring (cincin pengatur diopter)
Untuk menyamakan focus antara mata kanan dan kiri
- Interpupillar distance adjustment knob (pengatur jarak interpupillar)
- Specimen holder (penjepit spesimen)
- Illuminator (sumber cahaya)
- Vertical feed knob (sekrup pengatur vertikal)
Untuk menaikkan atau menurunkan object glass
- Horizontal feed knob (sekrup pengatur horizontal)
Untuk menggeser ke kanan / kiri objek glas
- Coarse focus knob (sekrup fokus kasar)
Menaik turunkan meja benda (untuk mencari fokus) secara kasar dan cepat
- Fine focus knob (sekrup fokus halus)
Menaik turunkan meja benda secara halus dan lambat
- Observation tube securing knob (sekrup pengencang tabung okuler)
- Condenser adjustment knob (sekrup pengatur kondenser)
Untuk menaik-turunkan kondenser
Prosedur Operasi
1. Menyalakan lampu
a. tekan tombol on (8)
b. atur kekuatan lampu dengan memutar bagian (7)
2. Menempatkan spesimen pada meja benda
a. Letakan objek glas diatas meja benda (4) kemudian jepit dengan (11). Jika meja benda belum turun, diturunkan dengan sekrup kasar (15)
b.Cari bagian dari objek glas yang terdapat preparat ulas (dicari dan diperkirakan memiliki gambar yang jelas) dengan memutar sekrup vertikal dan horizontal (13) dan (14)
3. Memfokuskan
a.  Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
 Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokus
Putar Revolving nosepiece (2) pada perbesaran objektif 4x lalu putar sekrup kasar (15) sehingga meja benda bergerak ke atas untuk mencari fokusb.Setelah fokus perbesaran 4 x 10 didapatkan, maka putar (2) pada perbesaran selanjutnya yaitu perbesaran objektif 10x. kemudian putar sekrup halus (16) untuk mendapatkan fokusnya
c. Lakukan hal yang sama jika menggunakan perbesaran yang lebih tinggi
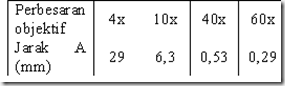
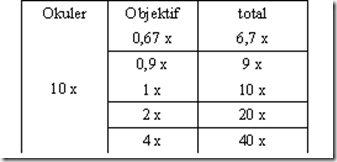
Berikut adalah tabel yang menunjukan jarak antara spesimen dengan lensa objektif jika okus telah didapatkan
Catatan: Setelah mendapatkkan fokus pada perbesaran tetentu, misal 40x, dan ingin memutar objektif ke perbesaran 100x, maka meja benda tidak perlu diturunkan dan tidak perlu khawatir bahwa lensa objektif akan menggesek cover glass karena terdapat sisa jarak A yang lebih kecil antara cover glass dengan lensa objektif (lihat tabel diatas).
4. Tambahan
a. Jika perlu interpupillar distance adjustment knob (10) dapat digeser, hal ini akan mengubah dua bayangan yang akan diterima oleh 2 mata menjadi gambar yang tunggal sehingga sangat membantu dalam mengatasi kelelahan mata
b. Jika perlu diopter adjustment knob (9) dapat diatur untuk memperoleh bayangan focus yang seimbang antara mata kanan dan kiri
c. Pengaturan condenser (5) akan memperjelas bayangan yang tampak dengan mensetting pada posisi tertinggi (cahaya penuh)
Perbesaran total
Ukuran specimen yang diamati dapat diperoleh dengan mengalikan perbesaran lensa okuler dengan lensa objektif. Misal = Okuler (10x) x Objektif (40x) = 400x
Penggunaan minyak imersi
Semakin kecil nilai daya pisah, akan semakin kuat kemampuan lensa untuk memisahkan dua titikyang berdekatan pada preparat sehingga struktur benda terlihat lebih jelas. Daya pisah dapat diperkuat dengan memperbesarkan indeks bias atau menggunakan cahaya yang memiliki panjang gelombang (λ) pendek. Biasanya dapat digunakan minyak imersi untuk meningkatkan indeks bias pada perbesaran 10 x 100
a. Jika fokus pada perbesaran 10 x 40 telah didapatkan maka putar ke perbesaran objektif 100x
b. tetesi minyak imersi 1 – 2 tetes dari sisi lensa
c. Jika telah selesai menggunakan mikroskop, bersihkan lensa objektif 100x dengan kertas lensa yang dibasahi xylol
· Mikroskop stereo (Zoom Stereo Microscope)
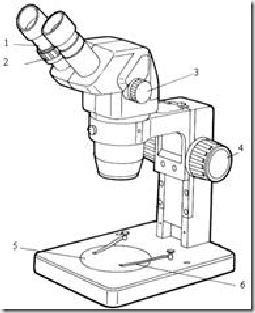 Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya digunakan untuk mengamati secara detail bentuk koloni dan jamur. Berikut merupakan uraian tentang mikroskop stereo yang dimiliki Laboratorium Mikrobiologi yaitu Zoom Stereo Microscope, Olimpus SZ3060.
Mikroskop ini berfungsi untuk melihat objek yang membutuhkan perbesaran tidak terlalu besar. Di Laboratorium Mikrobiologi, mikroskop stereo biasanya digunakan untuk mengamati secara detail bentuk koloni dan jamur. Berikut merupakan uraian tentang mikroskop stereo yang dimiliki Laboratorium Mikrobiologi yaitu Zoom Stereo Microscope, Olimpus SZ3060.1. Oculars eyepiece (lensa okuler)
2. Diopter adjustment ring (cincin pengatur diopter)
3. Zoom control knob (sekrup pengatur pembesaran)
4. Focusing knob (sekrup pengatur fokus)
5. Stage plate (pelat tempat specimen diletakkan)
6. Stage clip (penjepit spesimen / preparat)
Prosedur operasi
- Letakkan spesimen / preparat di stage plate (5), jepit jika perlu
- Atur perbesaran pada perbesaran terkecil dengan memutar Zoom Control Knob (3) kemudian dicari fokusnya dengan memutar Focusing Knob (4)
- Jika ingin mendapatkan bayangan yang lebih besar, putar Zoom Control Knob (3) ke perbesaran yang lebih tinggi kemudian dicari fokusnya
Mikroskop ini memiliki pilihan perbesaran:
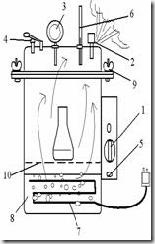
Autoklaf (Autoclave)
Diagram autoklaf vertical
1. Tombol pengatur waktu mundur (timer)
2. Katup pengeluaran uap
3. pengukur tekanan
4. kelep pengaman
5. Tombol on-off
6. Termometer
7. Lempeng sumber panas
8. Aquades (dH2O)
9. Sekrup pengaman
10. batas penambahan air
Autoclave adalah alat untuk mensterilkan berbagai macam alat dan bahan yang digunakan dalam mikrobiologi menggunakan uap air panas bertekanan. Tekanan yang digunakan pada umumnya 15 Psi atau sekitar 2 atm dan dengan suhu 121oC (250oF). Jadi tekanan yang bekerja ke seluruh permukaan benda adalah 15 pon tiap inchi2 (15 Psi = 15 pounds per square inch). Lama sterilisasi yang dilakukan biasanya 15 menit untuk 121oC.
Cara Penggunaan :
1. Sebelum melakukan sterilisasi cek dahulu banyaknya air dalam autoklaf. Jika air kurang dari batas yang ditentukan, maka dapat ditambah air sampai batas tersebut. Gunakan air hasil destilasi, untuk menghindari terbentuknya kerak dan karat.
2. Masukkan peralatan dan bahan. Jika mensterilisasi botol beretutup ulir, maka tutup harus dikendorkan.
3. Tutup autoklaf dengan rapat lalu kencangkan baut pengaman agar tidak ada uap yang keluar dari bibir autoklaf. Klep pengaman jangan dikencangkan terlebih dahulu.
4. Nyalakan autoklaf, diatur timer dengan waktu minimal 15 menit pada suhu 121oC.
5. Tunggu samapai air mendidih sehingga uapnya memenuhi kompartemen autoklaf dan terdesak keluar dari klep pengaman. Kemudian klep pengaman ditutup (dikencangkan) dan tunggu sampai selesai. Penghitungan waktu 15’ dimulai sejak tekanan mencapai 2 atm.
6. Jika alarm tanda selesai berbunyi, maka tunggu tekanan dalam kompartemen turun hingga sama dengan tekanan udara di lingkungan (jarum pada preisure gauge menunjuk ke angka nol). Kemudian klep-klep pengaman dibuka dan keluarkan isi autoklaf dengan hati-hati.
· Inkubator (Incubator)
Inkubator adalah alat untuk menginkubasi atau memeram mikroba pada suhu yang terkontrol. Alat ini dilengkapi dengan pengatur suhu dan pengatur waktu. Kisaran suhu untuk inkubator produksi Heraeus B5042 misalnya adalah 10-70oC..
· Hot plate stirrer dan Stirrer bar
 Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat dalam alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.
Hot plate stirrer dan Stirrer bar (magnetic stirrer) berfungsi untuk menghomogenkan suatu larutan dengan pengadukan. Pelat (plate) yang terdapat dalam alat ini dapat dipanaskan sehingga mampu mempercepat proses homogenisasi. Pengadukan dengan bantuan batang magnet Hot plate dan magnetic stirrer seri SBS-100 dari SBS® misalnya mampu menghomogenkan sampai 10 L, dengan kecepatan sangat lambat sampai 1600 rpm dan dapat dipanaskan sampai 425oC.Alat ini berguna untuk mempermudah perhitungan koloni yang tumbuh setelah diinkubasi di dalam cawankarena adanya kaca pembesar. Selain itu alat tersebut dilengkapi dengan skala/ kuadran yang sangat berguna untuk pengamatan pertumbuhan koloni sangat banyak. Jumlah koloni pada cawan Petri dapat ditandai dan dihitung otomatis yang dapat di-reset.
· Biological Safety Cabinet
Biological Safety Cabinet (BSC) atau dapat juga disebut Laminar Air Flow (LAF) adalah alat yang berguna untuk bekerja secara aseptis karena BSC mempunyai pola pengaturan dan penyaring aliran udara sehingga menjadi steril dan aplikasisinar UV beberapa jam sebelum digunakan. Prosedur penggunaan BSC seri 36212, Purifier™ Biological Safety Cabinet dari LABCONCO yang dimiliki labor atorium mikrobiologi adalah sebagai berikut:
atorium mikrobiologi adalah sebagai berikut:
 atorium mikrobiologi adalah sebagai berikut:
atorium mikrobiologi adalah sebagai berikut:1. Hidupkan lampu UV selama 2 jam, selanjutnya matikan segera sebelum mulai bekerja
2. Pastikan kaca penutup terkunci dan pada posisi terendah
3. Nyalakan lampu neon dan blower
4. Biarkan selama 5 menit
5. Cuci tangan dan lengan dengan sabun gemisidal / alkohol 70 %
6. Usap permukaan interior BSC dengan alkohol 70 % atau desinfektan yang cocok dan biarkan menguap
7. masukkan alat dan bahan yang akan dikerjakan, jangan terlalu penuh (overload) karena memperbesar resiko kontaminan
8. Atur alat dan bahan yang telah dimasukan ke BSC sedemikian rupa sehingga efektif dalam bekerja dan tercipta areal yang benar-benar steril
9. Jangan menggunakan pembakar Bunsen dengan bahan bakar alkohol tapi gunakan yang berbahan bakar gas.
10. Kerja secara aseptis dan jangan sampai pola aliran udara terganggu oleh aktivitas kerja
11. setelah selesai bekerja, biarkan 2-3 menit supaya kontaminan tidak keluar dari BSC
12. Usap permukaan interior BSC dengan alkohol 70 % dan biarkan menguap lalu tangan dibasuh dengan desinfektan
13. Matikan lampu neon dan blower
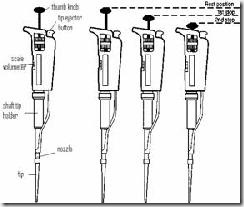
· Mikropipet (Micropippete) dan Tip
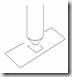
Mikropipet adalah alat untuk memindahkan cairan yang bervolume cukup kecil, biasanya kurang dari 1000 µl. Banyak pilihan kapasitas dalam mikropipet, misalnya mikropipet yang dapat diatur volume pengambilannya (adjustable volume pipette) antara 1µl sampai 20 µl, atau mikropipet yang tidak bisa diatur volumenya, hanya tersedia satu pilihan volume (fixed volume pipette) misalnya mikropipet 5 µl. dalam penggunaannya, mukropipet memerlukan tip.
Cara Penggunaan :
1. Sebelum digunakan Thumb Knob sebaiknya ditekan berkali-kali untuk memastikan lancarnya mikropipet.
2. Masukkan Tip bersih ke dalam Nozzle / ujung mikropipet.
3. Tekan Thumb Knob sampai hambatan pertama / first stop, jangan ditekan lebih ke dalam lagi.
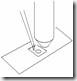
4. Masukkan tip ke dalam cairan sedalam 3-4 mm.
5. Tahan pipet dalam posisi vertikal kemudian lepaskan tekanan dari Thumb Knob maka cairan akan masuk ke tip.
6. Pindahkan ujung tip ke tempat penampung yang diinginkan.
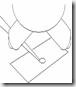
7. Tekan Thumb Knob sampai hambatan kedua / second stop atau tekan semaksimal mungkin maka semua cairan akan keluar dari ujung tip.
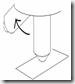
8. Jika ingin melepas tip putar Thumb Knob searah jarum jam dan ditekan maka tip akan terdorong keluar dengan sendirinya, atau menggunakan alat tambahan yang berfungsi mendorong tip keluar.
· Cawan Petri (Petri Dish)
Cawan petri berfungsi untuk membiakkan (kultivasi) mikroorganisme. Medium dapat dituang ke cawan bagian bawah dan cawan bagian atas sebagai penutup. Cawan petri tersedia dalam berbagai macam ukuran, diameter cawan yang biasa berdiameter 15 cm dapat menampung media sebanyak 15-20 ml, sedangkan cawan berdiameter 9 cm kira-kira cukup diisi media sebanyak 10 ml.
· Pipet Ukur (Measuring Pippete)
 Pipet ukur merupakan alat untuk memindahkan larutan dengan volume yang diketahui. Tersedia berbagai macam ukuran kapasitas pipet ukur, diantaranya pipet berukuran 1 ml, 5 ml dan 10 ml. Cara penggunaanya adalah cairan disedot dengan pipet ukur dengan bantuan filler sampai dengan volume yang diingini. Volume yang dipindahkan dikeluarkan menikuti skala yang tersedia (dilihat bahwa skala harus tepat sejajar dengan mensikus cekung cairan) dengan cara menyamakan tekanan filler dengan udara sekitar.
Pipet ukur merupakan alat untuk memindahkan larutan dengan volume yang diketahui. Tersedia berbagai macam ukuran kapasitas pipet ukur, diantaranya pipet berukuran 1 ml, 5 ml dan 10 ml. Cara penggunaanya adalah cairan disedot dengan pipet ukur dengan bantuan filler sampai dengan volume yang diingini. Volume yang dipindahkan dikeluarkan menikuti skala yang tersedia (dilihat bahwa skala harus tepat sejajar dengan mensikus cekung cairan) dengan cara menyamakan tekanan filler dengan udara sekitar. · Pipet tetes (Pasteur Pippete)
Fungsinya sama dengan pipet ukur, namun volume yang dipindahkan tidak diketahui. Salah satu penerapannya adalah dalam menambahkan HCl / NaOH saat mengatur pH media, penambahan reagen ada uji biokimia, dll.
· Tabung reaksi (Reaction Tube / Test Tube)

· Labu Erlenmeyer (Erlenmeyer Flask)
Berfungsi untuk menampung larutan, bahan atau cairan yang. Labu Erlenmeyer dapat digunakan untuk meracik dan menghomogenkan bahan-bahan komposisi media, menampung akuades, kultivasi mikroba dalam kultur cair, dll. Terdapat beberapa pilihan berdasarkan volume cairan yang dapat ditampungnya yaitu 25 ml, 50 ml, 100 ml, 250 ml, 300 ml, 500 ml, 1000 ml, dsb.
· Gelas ukur (Graduated Cylinder)
Berguna untuk mengukur volume suatu cairan, seperti labu erlenmeyer, gelas ukur memiliki beberapa pilihan berdasarkan skala volumenya. Pada saat mengukur volume larutan, sebaiknya volume tersebut ditentukan berdasarkan meniskus cekung larutan.
· Batang L (L Rod)
 Batang L bermanfaat untuk menyebarkan cairan di permukaan agar supaya bakteri yang tersuspensi dalam cairan tersebut tersebar merata. Alat ini juga disebut spreader.
Batang L bermanfaat untuk menyebarkan cairan di permukaan agar supaya bakteri yang tersuspensi dalam cairan tersebut tersebar merata. Alat ini juga disebut spreader.· Mortar dan Pestle
Mortar dan penumbuk (pastle) digunakan untuk menumbuk atau menghancurkan materi cuplikan, misal daging, roti atau tanah sebelum diproses lebih lanjut.
· Beaker Glass
Beaker glass merupakan alat yang memiliki banyak fungsi. Di dalam mikrobiologi, dapat digunakan untuk preparasi media media, menampung akuades dll..
Salah satu alat yang berfungsi untuk menciptakan kondisi yang steril adalah pembakar bunsen. Untuk sterilisasi jarum ose atau yang lain, bagian api yang paling cocok untuk memijarkannya adalah bagian api yang berwarna biru (paling panas). Perubahan bunsen dapat menggunakan bahan bakar gas atau metanol.
· Glass Beads
Glass Beads adalah manik-manik gelas kecil yang digunakan untuk meratakan suspensi biakan dengan menyebarkan beberapa butir di atas permukaan agar dan digoyang merata. Glass beads digunakan pada teknik spread plate yang fungsinya sama dengan batang L atau Spreader.
· Tabung Durham
Tabung durham berbentuk mirip dengan tabung reaksi namun ukurannya lebih kecil dan berfungsi untuk menampung/menjebak gas yang terbentuk akibat metabolisme pada bakteri yang diujikan. Penempatannya terbalik dalam tabung reaksi dan harus terendam sempurna dalam media (jangan sampai ada sisa udara).
· Jarum Inokulum
 Jarum inokulum berfungsi untuk memindahkan biakan untuk ditanam/ditumbuhkan ke media baru. Jarum inokulum biasanya terbuat dari kawat nichrome atau platinum sehingga dapat berpijar jika terkena panas. Bentuk ujung jarum dapat berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/Transfer needle. Inoculating loop cocok untuk melakukan streak di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum ini akan sangat bermanfaat saat membelah agar untuk preprasi Heinrich’s Slide Culture.
Jarum inokulum berfungsi untuk memindahkan biakan untuk ditanam/ditumbuhkan ke media baru. Jarum inokulum biasanya terbuat dari kawat nichrome atau platinum sehingga dapat berpijar jika terkena panas. Bentuk ujung jarum dapat berbentuk lingkaran (loop) dan disebut ose atau inoculating loop/transfer loop, dan yang berbentuk lurus disebut inoculating needle/Transfer needle. Inoculating loop cocok untuk melakukan streak di permukaan agar, sedangkan inoculating needle cocok digunakan untuk inokulasi secara tusukan pada agar tegak (stab inoculating). Jarum inokulum ini akan sangat bermanfaat saat membelah agar untuk preprasi Heinrich’s Slide Culture.Pinset memiliki banyak fungsi diantaranya adalah untuk mengambil benda dengan menjepit misalnya saat memindahkan cakram antibiotik.
· pH Indikator Universal
berguna untuk mengukur/mengetahui pH suatu larutan. Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
 Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.
Hal ini sangat penting dalam pembuatan media karena pH pada media berpengaruh terhadap petumbuhan mikroba. Kertas pH indikator dicelupkan sampai tidak ada perubahan warna kemudian strip warna dicocokkan dengan skala warna acuan.· Pipet Filler / Rubber Bulb
 Filler adalah alat untuk menyedot larutan yang dapat dipasang pada pangkal pipet ukur. Karet sebagai bahan filler merupakan karet yang resisten bahan kimia. Filler memiliki 3 saluran yang masing-masing saluran memiliki katup. Katup yang bersimbol A (aspirate) berguna untuk mengeluarkan udara dari gelembung. S (suction) merupakan katup yang jika ditekan maka cairan dari ujung pipet akan tersedot ke atas. Kemudian katup E (exhaust) berfungsi untuk mengeluarkan cairan dari pipet ukur.
Filler adalah alat untuk menyedot larutan yang dapat dipasang pada pangkal pipet ukur. Karet sebagai bahan filler merupakan karet yang resisten bahan kimia. Filler memiliki 3 saluran yang masing-masing saluran memiliki katup. Katup yang bersimbol A (aspirate) berguna untuk mengeluarkan udara dari gelembung. S (suction) merupakan katup yang jika ditekan maka cairan dari ujung pipet akan tersedot ke atas. Kemudian katup E (exhaust) berfungsi untuk mengeluarkan cairan dari pipet ukur.














 Logging you in...
Logging you in...
Jual minyak argan · 352 weeks ago
inex99 22p · 179 weeks ago
slot indonesia
situs slot
mesin slot
situs pulsa
slotrtp
rtpslot
situsrtpslot
situs deposit 5000
cracked-apps · 153 weeks ago
inkscape full crack
karafun player full crack
crack mp4 to mp3 converter
frederick292 4p · 149 weeks ago
Cellobet · 146 weeks ago
fani · 139 weeks ago
Bobby · 82 weeks ago